Ensayos clínicos: tratamientos del futuro para el paciente del presente
¿Qué es un ensayo
clínico?
Los ensayos
clínicos son estudios de investigación en los que participan personas que tiene
como objetivo encontrar mejores formas de prevenir, examinar, diagnosticar o
tratar una enfermedad. Los estudios pueden centrarse en analizar la efectividad
y seguridad de medicamentos nuevos o combinaciones de medicamentos, nuevos
aparatos o procedimientos quirúrgicos, o nuevas maneras de usar los
tratamientos existentes. Estos experimentos permiten obtener información sobre
la respuesta del cuerpo humano ante un tratamiento en una situación de buena
salud o enfermedad concreta. Además, sirven para evaluar posibles efectos
secundarios o daños derivados del uso de un aparato o un procedimiento
quirúrgico.
Hay ensayos
clínicos con diferentes objetivos: diagnóstico, prevención, conducta, calidad
de vida, detección y tratamiento. Cada estudio tiene criterios de inclusión que
describen las características quiénes pueden participar, y criterios de
exclusión que explican las condiciones que no pueden tener los participantes
porque pueden alterar los resultados. Los ensayos clínicos incluyen voluntarios
de diferente sexo, edades y a personas de diferentes poblaciones o etnias, para
conseguir la mayor representatividad posible.
En primer lugar, los medicamentos, aparatos o procedimientos nuevos tienen su origen y se estudian en un laboratorio. Después, aquellos que son prometedores pasan a ser investigados en animales, y finalmente se estudian más profundidad en personas por medio de ensayos clínicos. A medida que los estudios atraviesan una serie de fases, los investigadores obtienen más información sobre el tratamiento, sus riesgos y su eficacia.
 | |
|
Desarrollo y
fases de los ensayos clínicos
Un investigador principal (PI) dirige el ensayo clínico, que se lleva a cabo por un equipo de investigadores—normalmente integrado por profesionales de la salud de diferentes áreas: médicos, enfermeras, trabajadores sociales, nutricionistas u otros—encargados de monitorizar la salud de los participantes, y determinar la eficacia y seguridad del procedimiento, aparato o medicamento estudiado. Todos los medicamentos, aparatos o procedimientos quirúrgicos disponibles hoy en día, ya sea en el hospital o en la farmacia, han pasado los ensayos clínicos, siguiendo un protocolo exhaustivo en el que se hacen pruebas, se recogen datos y muestras biológicas a lo largo de diferentes fases. Esta información es vital para las organizaciones oficiales de cada país para decidir si autorizar o no un determinado medicamento, aparato o procedimiento y para determinar qué es más adecuados para cada paciente.
 |
| Sanchez-Gómez, et al. Tipología de estudios clínicos. ISCIII 2020. |
- Diseño abierto: el equipo de investigadores y los participantes saben el grupo al que se le ha asignado. Tiene riesgo de múltiples sesgos debidos al participante y al equipo de investigación.
- Simple ciego:
al participante no se le informa de tratamiento, pero el equipo lo sabe. Hay
riesgo de sesgos asociados al investigador y al análisis.
- Doble ciego: ni los participantes ni el equipo de investigadores sepan qué tratamiento ha recibido cada voluntario, solo el analista por lo que se minimiza el riesgo de sesgos a los sesgos en el análisis.
- Triple ciego: para obtener los datos científicamente más exactos, el equipo investigador, participantes y los analistas de datos desconocen el grupo al que pertenece cada voluntario y todo está codificado, de forma que es muy difícil cometer sesgos.
 |
| Sanchez-Gómez, et al. Tipología de estudios clínicos. ISCIII 2020. |
- Fase I: Esta primera fase incluye participantes, voluntarios, con buena salud y, por tanto, sin la enfermedad para la que se hace el ensayo. El objetivo principal es evaluar la seguridad para el ser humano de un determinado medicamento, aparato o procedimiento en un pequeño grupo de personas sanas (menos de 100 participantes). En este tipo de ensayos se prueba el medicamento evaluando la dosis segura, o la seguridad en la forma de uso de un aparato o procedimiento, sin compararlo con otros, y suele tener una duración de días hasta un año.
- Fase II: Tras el primer ensayo en personas sanas, en esta fase se prueba el medicamento, aparato o procedimiento en un pequeño grupo de pacientes enfermos (de 100 a 300 participantes, comparando o no con otro tratamiento) por 2 o 3 años. Esta fase tiene como finalidad conseguir los primeros datos sobre su seguridad, el mejor protocolo, y los posibles beneficios.
- Fase III: Este es el último paso antes de que se apruebe el medicamento, aparato o procedimiento, y se realiza en un gran grupo de pacientes (de 300 a 3.000 participantes) con la enfermedad, comparándolo con el tratamiento de referencia, durante un periodo de tiempo largo, de entre 1 y 4 años. Si se completa demostrando que el nuevo medicamento, aparato o procedimiento presenta mejoras frente al estándar, con un alto nivel de seguridad y efectividad en las condiciones de enfermedad fijadas, se comienzan los trámites para que las autoridades de registro autoricen la comercialización en el caso de los medicamentos o productos, y finalmente salga al mercado.
- Fase IV: Esta fase se hace una vez aprobado el medicamento, aparato o procedimiento quirúrgico, tras aproximadamente 10 años de estudio, para evaluar los efectos a largo plazo, vigilar los efectos secundarios en miles de personas, y evaluar la posibilidad de extender su uso en otras condiciones. Este estudio también sirve para evaluar el potencial del medicamento, aparato o procedimiento sirve para casos complejos de pacientes con más enfermedades—además que la que fue objetivo del estudio—así como para probar combinaciones de medicamentos para estas situaciones complejas. Esta fase dura largos periodos de tiempo y se considera una vigilancia posterior a la comercialización.
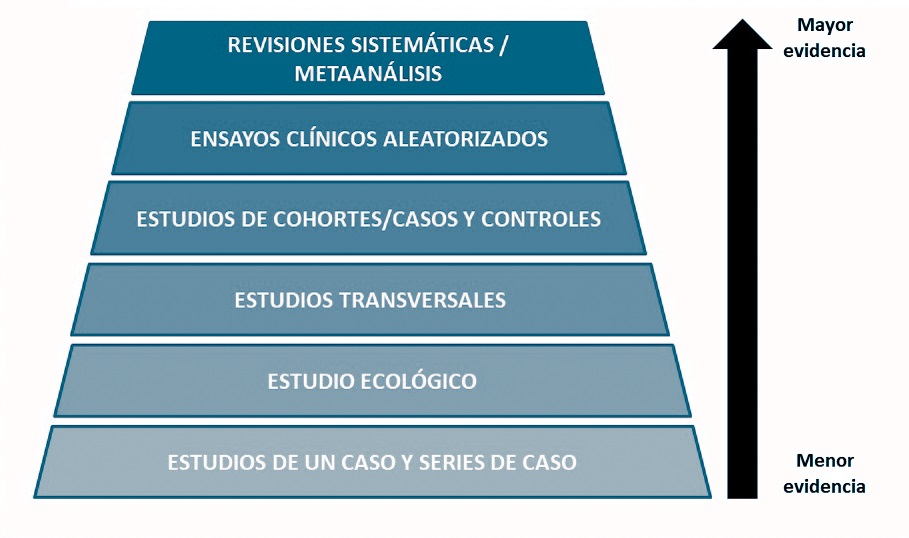
Por el contrario,
en los estudios observacionales no hay
control de selección e intervención, y el equipo de investigación solo lleva a
cabo la observación, medición y análisis. Estos estudios pueden ser de diferentes tipos, con
características, objetivos y posibilidades distintas: estudios de cohortes,
casos controles, transversales, ecológicos y estudios de caso o series de caso.
De algunos de estos estudios escribiré una entrada en otra ocasión, ya
que son muy importantes a nivel poblacional y se utilizan mucho en epidemiología
y salud pública.
Aspectos éticos y
regulación
Los ensayos
clínicos siguen unas normas internacionales y nacionales para cumplir con
la ética y legalidad, y se llevan a cabo siguiendo de forma estricta los
protocolos que describen lo que se va a hacer, a qué participantes, cómo, para
qué y cada cuánto tiempo. Lo más importante es la seguridad de los voluntarios
del ensayo clínico, además de su libertad para participar o abandonarlo cuando
quieran, sin que condicione para ser atendidos más adelante por el sistema
sanitario. Los datos de los participantes siempre van a ser tratados con
la privacidad y confidencialidad necesaria.
En primer lugar,
un comité de ética de la investigación acreditado evalúa los aspectos
metodológicos, éticos y legales del ensayo para que se pueda llevar a cabo el
estudio, así como sus modificaciones, y hace el seguimiento desde inicio al
fin. El objetivo es proteger los derechos y bienestar de los participantes e
identificar los riesgos y beneficios potenciales. Un comité de
ética de la investigación con medicamentos (CEIm) está formado por un
mínimo de 10 miembros: al menos uno de ellos será ajeno a la investigación
biomédica o a la asistencia clínica (miembro lego, es decir, no-profesional o
no experto en la materia), que representará los intereses de los pacientes.
Entre los miembros del comité hay médicos (al menos un médico especialista en
farmacología clínica, de acceso mediante el sistema MIR), un farmacéutico (de
hospital o de atención primaria, de acceso mediante especialidad FIR) y un
diplomado o graduado en enfermería. Al menos dos miembros deben ser ajenos a
las profesiones sanitarias, uno de los cuales deberá ser licenciado o graduado
en derecho. Además, al menos uno de los miembros debe tener formación acreditada
en bioética.
Una vez que se
completa la fase III, si el ensayo clínico demuestra que el medicamento o
producto tiene buenos resultados, la autoridad sanitaria correspondiente evalúa
los resultados finales de los ensayos clínicos. Cada país o región tiene una
autoridad sanitaria—en España, la Agencia Española de Medicamentos y Productos Sanitarios, AEMPS adscrita al Ministerio de Sanidad, y en
la Unión Europea la Agencia Europea de Medicamentos—que evalúa los ensayos clínicos y aprueba los medicamentos o productos sanitarios para su comercialización.
Para buscar
ensayos clínicos, puede visitar el sitio web en inglés de ClinicalTrials.gov (la base de datos de ensayos clínicos más
grande del mundo, a cargo del NIH de Estados Unidos pero que contiene estudios
de la mayoría de países), la web de Registro de ensayos clínicos de la Unión Europea y el Registro Español de estudios clínicos.
Fuentes
Documentos
técnicos y normativa sobre medicamentos
En la sede de la
AEMPS del Ministerio de Sanidad se puede encontrar la web sobre la Legislación española sobre ensayos
clínicos con medicamentos de uso humano (English version), que incluye:
·
Ley de garantías y uso racional de los medicamentos y
productos sanitarios
·
Reales
Decretos por los que se
regulan los ensayos clínicos con medicamentos, los Comités de
Ética de la Investigación con medicamentos y el Registro Español de Estudios
Clínicos y los laboratorios farmacéuticos, los fabricantes de
principios activos de uso farmacéutico y el comercio exterior de medicamentos y
medicamentos en investigación
·
Orden por la que se establecen los principios y las directrices detalladas de buena
práctica clínica y los requisitos para autorizar la fabricación o importación
de medicamentos en investigación de uso humano
·
Resolución
por la que se autoriza la presentación a través del registro electrónico del
departamento de determinados escritos, comunicaciones y solicitudes relativos a
ensayos clínicos con medicamentos dirigidos a Comités Éticos de Investigación
Clínica o a la Agencia Española de Medicamentos y Productos Sanitarios.
Documento de Instrucciones para la
realización de ensayos clínicos en España (English version), Versión 17: 18 de noviembre de 2022
Sanchez-Gomez, et al. Tipología de estudios clínicos. Grupo de Análisis Científico de Coronavirus del ISCIII (GACC-ISCIII). 2020-06-16
Documentos
técnicos y normativa sobre productos sanitarios, cosméticos y cuidado personal.
Otras fuentes
www.geicam.org/que-hacemos/ensayos-clinicos/que-es-un-ensayo-clinico
www.ensayosclinicosroche.es/es/faq/what-is-a-clinical-trial.html
www.cun.es/investigacion/ensayos-clinicos
www.kidneyfund.org/es/treatments-los-ensayos-clinicos/que-es-un-ensayo-clinico
www.nhlbi.nih.gov/es/investigacion/ensayos-clinicos/como-funcionan
www.nimh.nih.gov/health/trials/ensayos-clinicos-informacion-para-los-participantes/




Comentarios
Publicar un comentario
Si deseas recibir más información sobre mi proyecto, tienes sugerencias o comentarios acerca del blog ¡no dudes en escribirme! estaré encantada de resolver todas tus dudas.